Der Unterschied zwischen VIS-Spektroskopie und NIR-Spektroskopie
Sichtbares Licht und Infrarot
Spektroskopie funktioniert im Bereich des sichtbaren Lichts, aber auch im UV- und Infrarotbereich. In allen Fällen handelt es sich um dieselbe elektromagnetische Strahlung, nur die jeweiligen Wellenlängen unterscheiden sich. Und doch werden die einzelnen Bereiche meist unterschiedlich genutzt: Der sichtbare (VIS-)Bereich findet seine Anwendung meist in der Farbmessung und, dank der Fraunhofer-Linien, auch beim Nachweis von verschiedenen Elementen. Infrarot (IR) hingegen wird in der Regel für quantitative Analyse genutzt, also für das Bestimmen von Mengenverhältnissen in Mischungen (z.B. dem Eiweißgehalt in Bohnen, oder den verschiedenen Fettsäuren in Pflanzenölen). Woran liegt das? Ist das einfach Konvention, oder gibt es dafür physikalische Ursachen?
Wie absorbieren Stoffe die Energie im Licht?
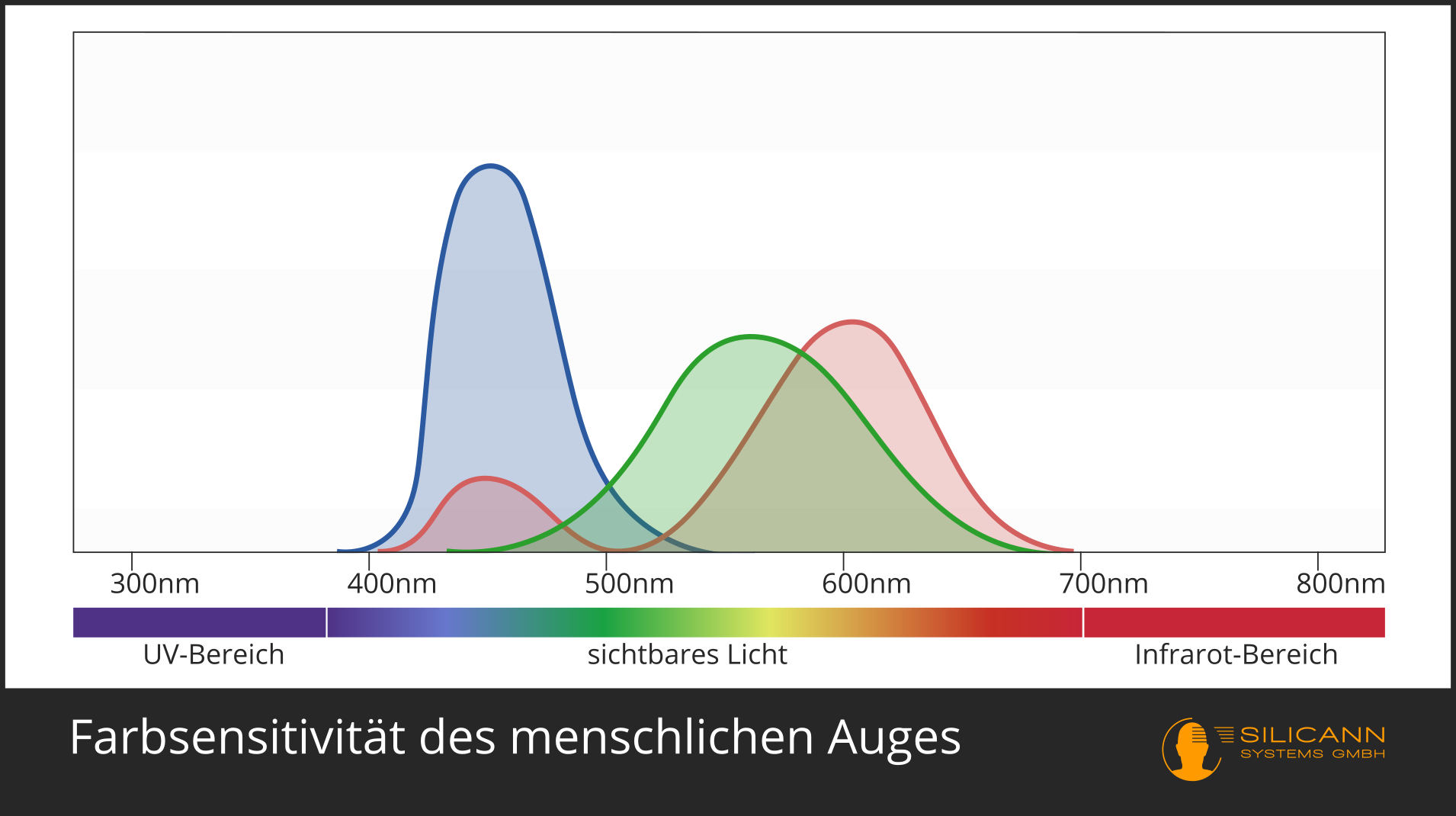
Bei der Farbmessung ist die Antwort noch klar: Das geht natürlich nur im VIS-Bereich. Ein Spektrometer kann die gesamten Wellenlängen analysieren und daraus genau den Farbeindruck berechnen, den dieses Spektrum für das menschliche Auge produzieren würde. Das ist nicht ganz trivial, weil Farbe nicht objektiv existiert, sondern eine Konstruktion unseres Sehsystems ist: Wir haben drei verschiedene Rezeptoren, die jeweils unterschiedlich sensitiv für verschiedene Wellenlängen sind, die grob dem roten, grünen und blauen Bereich entsprechen. Alle anderen Farben entstehen dann durch Verschaltungen dieser Rezeptor-Signale miteinander. Unsere Augen und die der meisten anderen Tiere haben sich speziell für diese Wellenlängen entwickelt, weil das genau der Teil der elektromagnetischen Strahlung ist, in dem unser Stern am stärksten strahlt.
Elektromagnetische Strahlung wird sich im Modell als eine Mischung aus wellenförmiger und Teilchen-Strahlung vorgestellt. Die Teilchen werden Photonen oder auch Quanten genannt. Die Energie, die ein Photon mit sich trägt, ist nicht immer gleich, sondern ist abhängig von der Wellenlänge der Strahlung.
Dabei gilt: je kleiner die Wellenlänge, desto größer die Energie. Sichtbares Licht ist kurzwelliger als Infrarot, also ist es auch energiereicher. Röntgen- und UV-Strahlung sind noch kurzwelliger, und deshalb bereits schädlich für die Zellen vieler Organismen.
Die Grundlage für beide Phänomene, Farbe genau wie UV-Strahlung, die Zellen zerstört, ist die Tatsache, dass Atome elektromagnetische Strahlung aufnehmen bzw. absorbieren können. Dabei absorbieren bestimmte Atome nur Strahlung bestimmter, recht enger Wellenlängenbereiche. Dadurch entstehen dann z.B. auch die Fraunhofer-Linien.
Aber warum ist das so? Warum wird nicht die gesamte eingehende Strahlung absorbiert? Die Antwort auf diese Frage begründete gleichzeitig die Quantenphysik.
Die Quantenebene
Einfallende Photonen treffen auf die Elektronen eines Atoms, die ja je nach Element mehr oder weniger frei um den Atomkern kreisen. Sie nehmen die Energie der Photonen auf und ändern dadurch ihre Umlaufbahn um den Kern (sie ändern ihr Energieniveau). Laut der klassischen Vorstellung der Physik müsste eigentlich jede beliebige Energieaufnahme zu einer entsprechend kleinen Umlaufbahnänderung führen. Experimente haben Anfang des 20. Jahrhunderts aber gezeigt, dass das offenkundig nicht der Fall war.
Nils Bohr lieferte damals ein Atommodell, das annahm, dass Elektronen ihre Umlaufbahnen nicht je nach verfügbarer Energie frei wählen können, sondern es fest definierte Bahnen gibt, zwischen denen ein Elektron nur ganz oder gar nicht springen kann. Das bedeutet aber auch, dass es nur ganz bestimmte Energiemengen aufnehmen kann, nämlich immer nur genau die Menge, die exakt für einen (oder zwei oder drei ...) Sprünge ausreicht.
Nur die Photonen, deren Energie genau der Energie entspricht, die für den Sprung eines Elektrons auf ein höheres Energieniveau nötig ist, wird also absorbiert. Die genaue Größe dieser Energiemenge hängt vom jeweiligen Material ab.
Die Wirkung dieser Quanteneffekte können wir tatsächlich mit bloßem Auge erkennen: Gäbe es keine Quanteneffekte, dann würde jedes Energieniveau mit Strahlung erreicht werden können. Dann hätten wir weder unterschiedliche Farben noch die schmalen Fraunhofer-Linien im Spektrum.
IR-Spektroskopie
Bei Molekülen ist das ähnlich. Die Bindung der Atome zu einem Molekül geschieht, indem sich Atome einzelne recht bewegliche Elektronen teilen. Das sind die Valenzelektronen. Die Moleküle sind nicht fest verbunden und unbeweglich, sondern schwingen auf vielfältige Weise im Raum herum. In einem einfachen Modell kann man sich eine Atombindung wie eine Metallfeder zwischen den Atomen vorstellen. Die Feder hält die Atome zusammen, erlaubt aber das Strecken und Stauchen der Verbindung. Aber auch z.B. ein Verdrehen entlang der Verbindungsachse ist möglich. Je nach Aufbau eines Moleküls gibt es dabei ganz unterschiedliche Freiheitsgerade der Schwingung.
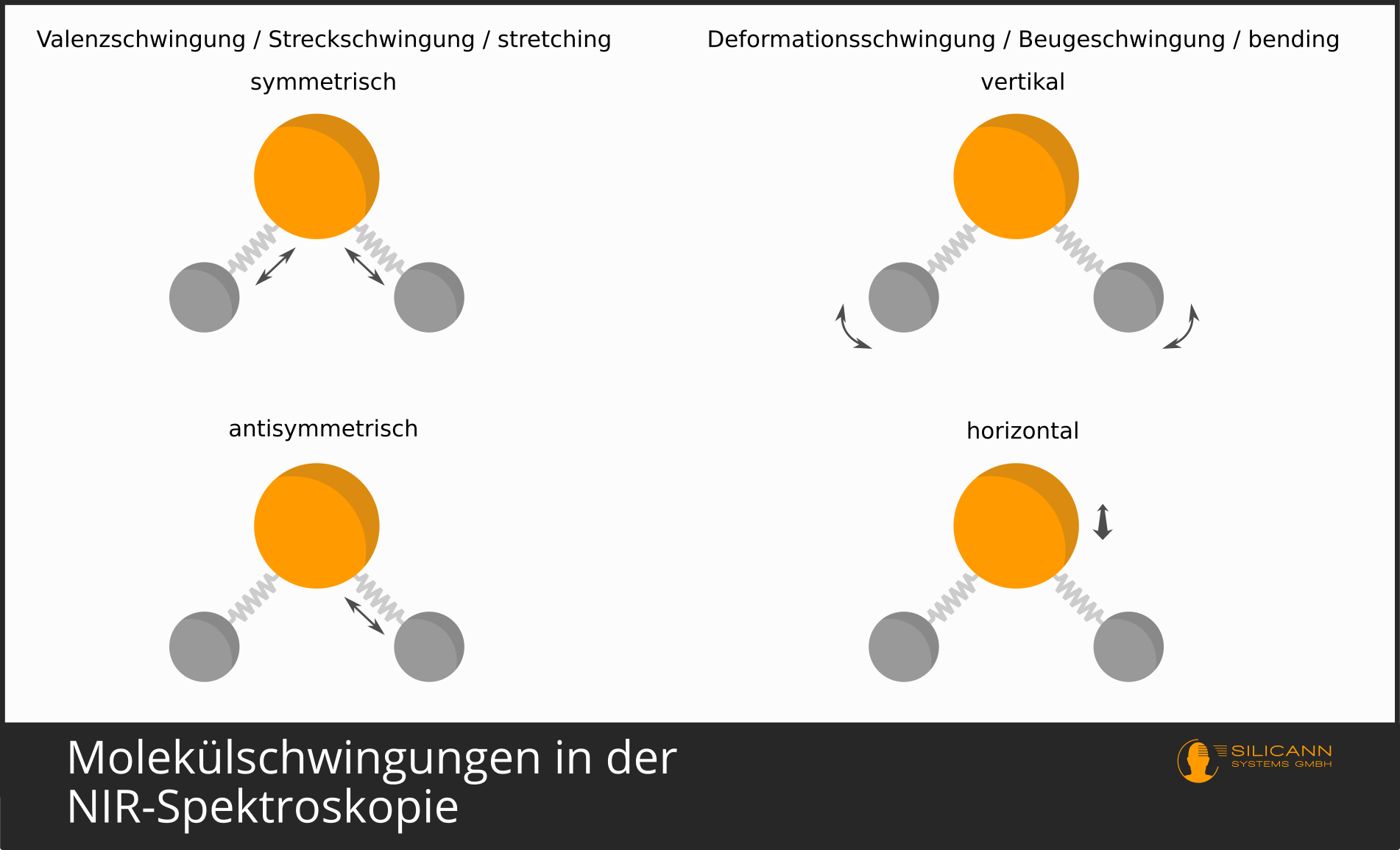
Auch diese Schwingungen finden ja in atomaren Größenordnungen statt, und deshalb sind auch die Schwingungen nicht über beliebige Distanzen möglich, sondern nur in diskreten, gequantelten Schritten. Und, Sie werden es ahnen, auch hier gilt wieder, dass nur bestimmte Wellenlängen genau den Energiemengen entsprechen, die benötigt werden, um die Schwingungen um genau einen (oder zwei, oder drei) Einheiten stärker auszuprägen.
Weil es mehrere Richtungen gibt, entlang denen ein Molekül schwingen kann, dann sind die einzelnen Schwingungen im Spektrum sehr häufig nicht einzeln auszumachen. Deshalb sieht man in Infrarot-Spektren dann meist auch eher angeregte Schwingungsbande, also etwas breitere Wellenlängenbereiche, als die sehr präzisen Linien im sichtbaren Wellenlängenbereich.
Grundschwingungen und Oberschwingungen
Eben wurde angedeutet, dass Moleküle bei Anregung zwar meist nur um ein Energieniveau stärker schwingen. Dieser Sprung um ein Energieniveau wird Grundschwingung genannt. Er findet am häufigsten statt. Entsprechend wird eine mit Infrarot bestrahlte Probe auch sehr viele Moleküle zum stärkeren Schwingen in der Grundschwingung bringen. Weil viele Moleküle angeregt wurden, ist die Grundschwingung deshalb auch im Infrarot-Spektrum überwiegend klar zu erkennen. Bei den meisten organischen Verbindungen findet die Grundschwingung im Bereich des mittleren Infrarots statt, d.h. bei Wellenlängen zwischen 2500 und 5000 nm.
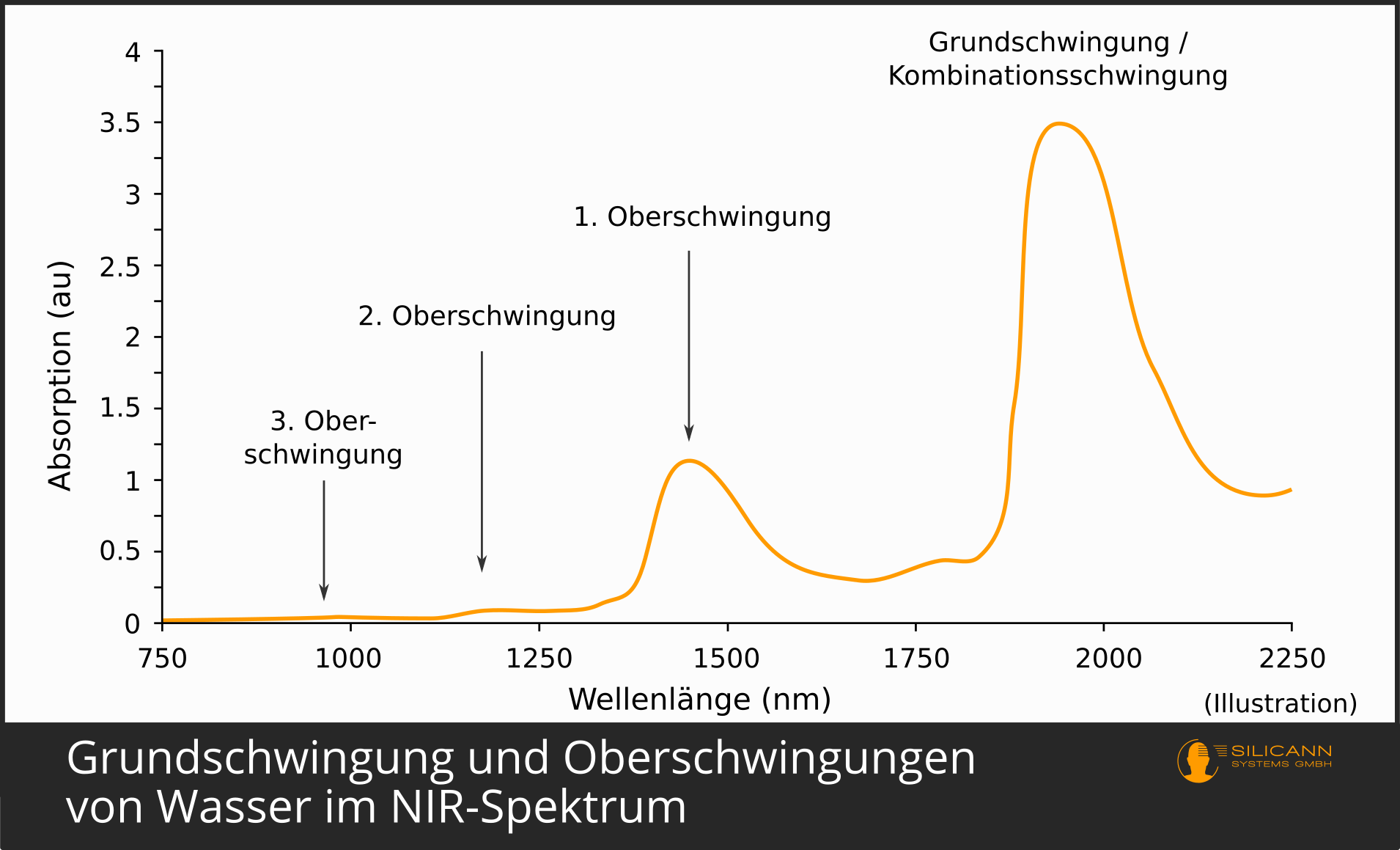
Deutlich seltener kann es jedoch vorkommen, dass ein Molekül gleich die doppelte Energiemenge aufnimmt. Dieser Fall wird dann als erste Oberschwingung im Spektrum sichtbar. Die Energie stammt wieder aus der Infrarotstrahlung. Da im Falle der Oberschwingung mehr Energie benötigt wird, müssen die Photonen auch mehr Energie liefern - sie müssen also kurzwelliger sein. Oberschwingungen sind also immer in kleineren Wellenlängen zu finden, bei organischen Verbindungen meist im Nahinfrarot-Bereich von 800 bis 2500 nm.
Weil der Fall des Doppelsprungs seltener stattfindet, sind insgesamt auch weniger Moleküle in der Probe unter dem Spektrometer betroffen. Damit ist der Ausschlag im Spektrum auch deutlich kleiner als derjenige der Grundschwingung: Grundschwingungen sind also grundsätzlich leichter nachweisbar als Oberschwingungen.
Bei der 2. Oberschwingung gilt dasselbe: Sie passiert noch seltener, benötigt noch höheren Energiebedarf für den Sprung, die Schwingung ist entsprechend noch kurzwelliger, und im Spektrum führt sie zu einem deutlich kleineren Peak als die erste Oberschwingung.
Anwendungsfälle von Infrarot-Spektroskopie
Die Schwingungen der Moleküle sind immer charakteristisch für ganz bestimmte Verbindungen: Das Stretching einer CH-Verbindung innerhalb des Moleküls würde sich als Grundschwingung um 3460 nm bemerkbar machen, eine C≡C-Dreifachbindung bei rund 4700 nm usw.
Aus der Charakteristik eines aufgenommenen Infrarotspektrums lassen sich also Schlüsse über die Substanz ziehen, die vom Spektrometer untersucht wurde, bis hin zur präzisen Bestimmung des chemischen Aufbaus eines unbekannten Stoffs. Das funktioniert dann besonders gut, wenn klar ist, dass es sich bei der unbekannten Probe um einen einzelnen Stoff handelt.
Sehr häufig wird insb. in der Industrie die Infrarot-Spektroskopie auch zur quantitativen Bestimmung von Inhalten genutzt. Ein typisches Beispiel wäre etwa die Bestimmung von Fett- und Eiweißgehalt in Milch oder Milchprodukten. Hier geht es also um die Anteile mehrerer gemischter Stoffe in einer Probe.
Die Vorgehensweise ist in diesen Fällen meist eine andere: Eine ganze Reihe von Proben wird zunächst gleichzeitig spektral untersucht und z.B. mit klassischen nasschemischen Methoden auf ihre Zusammensetzung hin analysiert. Liegt eine genügend große Probenmenge vor, dann können algorithmisch die Zusammenhänge zwischen den Bestandteilen und den spezifischen Spektren herausgefunden werden. Am Ende liegt dann eine Bewertungsmethode vor, die von nun rein spektral die Anteile von Fett und Eiweiß in der Probe kennen kann.



